
(4.58)
Для получения рассчетного выражения изменения энтропии идеальных газов воспользуемся первым законом термодинамики, в котором теплота определяется с использованием изменения энтальпии
 |
(4.58) |
Для идеального газа изменение энтальпии определяется как dh=cPdT, а удельный объем v=RT/P. Подставив данные выражения изменения энталпии и удельного объема в уравнение (4.58), получим уравнение для изменения энтропии идеального газа
 |
(4.59) |
Разность энтропий идеального газа в конкретных двух состояниях можно получить интегрированием выражения (4.59)
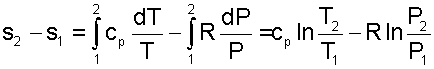 |
(4.60) |
Воспользовавшись формулой Майера сР=сV+R и уравнением Менделеева-Клапейрона Pv=RT, выражение (4.60) можно записать и через две другие пары термических параметров состояния
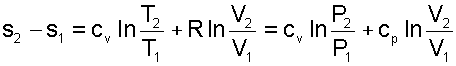 |
(4.61) |
Для определения абсолюного значения энтропии идеального газа необходимо зафиксировать начало ее отсчета любой парой термических параметров состояния. Например, приняв s0=0 при Т0 и Р0, воспользовавшись уравнением (4.60), получим
 |
(4.62) |
Выражение (4.62) свидетельствует о том, что энтропия идеального газа есть параметр состояния, поскольку ее можно определить через любую пару параметров состояния. В свою очередь, поскольку энтропия сама является параметром состояния, используя ее в паре с любым независимым параметром состояния, можно определить любой другой параметр состояния газа.
| предыдущий параграф | содержание | следующий параграф |