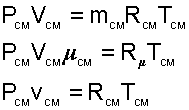
Для того чтобы воспользоваться уравнением Менделеева-Клапейрона для смеси газов
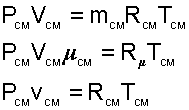 |
необходимо знать газовую постоянную RСМ и молярную массу (условную) смеси µСМ. Для смеси, как для любого идеального газа, эти две величины связаны соотношением RСМ=8314/µСМ (Дж/(кг•К)). Чтобы рассчитать эти величины, необходимо знать состав смеси газов, т.е. какие газы и в какой пропорции входят в смесь.
Состав смеси может быть задан массовыми, объемными или мольными долями.
Массовой долей gi данного газа называется отношение его массы к массе всей смеси:
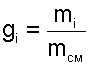 |
(4.67) |
Очевидно, что сумма массовых долей всех газов смеси равна единице:
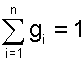 |
(4.68) |
Объeмной долей ri данного газа называется отношение объема, который занимал бы данный газ при температуре и давлении смеси, к общему объему смеси:
 |
(4.69) |
Объем Vi называют парциальным объемом, это искусственно введенная величина, поскольку каждый газ, входящий в смесь, занимает весь объем смеси. Парциальный объем можно рассчитать по уравнению Менделеева – Клапейрона:
 |
(4.70) |
Записав уравнение Менделеева – Клапейрона через парциальное давление и через парциальный объем,
 |
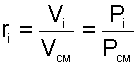 |
(4.71) |
Поскольку сумма парциальных давлений равна давлению смеси, то сумма объемных долей всех газов смеси равна единице, а сумма парциальных объемов равна полному объему всей смеси газов:
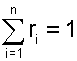 |
(4.72) |
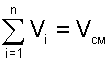 |
(4.73) |
Для смеси газов используется понятие мольных долей. Мольной долей называется отношение количества молей данного газа Мi к общему количеству молей всех газов смеси МСМ.
Количество молей определяется делением массы газа на его молярную массу:
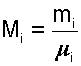 |
(4.74) |
Воспользовавшись уравнением Менделеева – Клапейрона для парциального и полного объемов смеси газов и введя в него количество молей
 |
 |
 |
(4.75) |
Равенство объемных и мольных долей для смеси газов можно получить и из закона Авогадро, в соответствии с которым объемы молей всех идеальных газов при одинаковых параметрах одинаковы, т.е. число молей при одинаковых параметрах идеальных газов прямо пропорционально полным объемам этих газов: Vμ i=Vi/Мi=VСМ/МСМ=Vμ СМ.
Существует взаимосвязь массовых и объемных долей смеси. Ее несложно получить, выразив массы газов через произведение их объемов на плотности, а отношение плотностей при одинаковых параметрах, в соответствии с законом Авогадро, заменив отношением молярных масс:
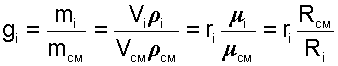 |
(4.76) |
Уравнение (4.76) позволяет получить расчетные выражения для молярной массы и газовой постоянной смеси газов на основании равенства единице суммы массовых и объемных долей всех газов данной смеси:
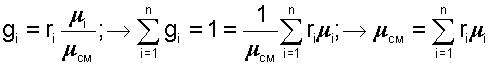 |
(4.77) |
 |
(4.78) |
При известной молярной массе смеси газовую постоянную смеси проще определить из соотношения
 |
Для определения парциального давления данного газа в смеси можно воспользоваться выражением (4.71). В соответствии с ним
| предыдущий параграф | содержание | следующий параграф |