(5.44)
Рассчитанные по квантовой теории значения теплоемкостей идеальных газов cP и cV для различных температур позволяют аппроксимировать их зависимость от температуры в степенной полином вида
(5.44) |
Таким образом, мы имеем функциональную зависимость cP=F1(t) и cV=F2(t). В принципе достаточно знать функциональную зависимость cP или cV от температуры, поскольку для идеальных газов cP = cV + R. На практике для удобства расчетов в справочных таблицах приводят обе теплоемкости как функции от температуры.
Зная зависимости cP и cV от температуры, можно рассчитать энергетические параметры идеальных газов u, h, s, используя уравнение состояния идеального газа и первый закон термодинамики.
В таблицах термодинамических свойств газов [9,12] расчет энергетических параметров совмещен с расчетом обратимого адиабатного процесса. Такое совмещение имеет определенную целесообразность, т.к. адиабатный процесс имеет широкое распространение в практике (в компрессорах, газовых турбинах, двигателях внутреннего сгорания и т.п.), кроме того, этот процесс довольно громоздкий в своей расчетной части.
Расчет других процессов идеальных газов так же может осуществляться по этим таблицам, но в этом случае определение всех энергетических параметров ведется только по температурам.
Рассмотрим принцип построения таких таблиц и их использование для расчета газовых процессов.
В основу построения этих таблиц положены уравнения первого закона термодинамики для обратимого адиабатного процесса идеального газа:
 |
Поделив эти уравнения на уравнение состояния идеального газа Pv=RT, получим соотношения:
 |
(5.45) |
 |
(5.46) |
Зафиксировав начало адиабатного процесса в виде точки с постоянными параметрами Р0, T0, v0, проинтегрируем эти выражения от точки на адиабатном процессе с температурой Т0 до точки с температурой Т и соответствующими ей Р и v (рис.4.15). В результате интегрирования получим выражения:
 |
(5.47) |
 |
(5.48) |
Введем понятия относительного объема θO=v/vO и относительного давления πO=р/рO:
 |
(5.49) |
 |
(5.50) |
Для адиабатного процесса 1-2 с параметрами в начальной точке Р1, T1 и v1 и в конечной точке Р2, T2 и v2 относительные объемы и давления будут рассчитываться в соответствии с уравнениями (5.35) и (5.36) по формулам:
 |
Из этих формул следует, что для адиабатного процесса справедливы соотношения:
 |
(5.51) |
 |
(5.52) |
Величины относительных объемов и давлений есть функции одного параметра - температуры, поскольку Т0 мы приняли в виде постоянной величины, а сP и сV являются функциями температуры. При этом численные значения величин Р0 и v0 никакой роли не играют (их нет), поскольку в расчетах адиабатного процесса используют относительные давления и объемы, а они зависят только от Т0 и Т.
| Рис. 5.15 | Рис. 5.16 |
Для наглядности этого утверждения на рис.5.16 показаны два адиабатных процесса, проходящих в одном и том же интервале температур Т1 и Т2. Приняв для этих адиабат одинаковую температуру Т0, можно записать следующие соотношения:
 |
Из этих соотношений видно, что несоответствие энтропии s01 адиабатного процесса 1-2 с энтропией s0a процесса а-в на расчет процессов не влияют, т.е. различие в численных значениях давлений и объемов в этих процессах при Т0 не влияет на отношение давлений и объемов в этих процессах, и если они проходят в одинаковых интервалах температур, то и отношения давлений и объемов будут одинаковы.
Это объясняется тем, что все изобары и изохоры идеальных газов в Т,s- диаграмме - эквидистантные кривые. Характер изобары в Т,s- диаграмме определяет теплоемкость сP, а изохоры - сV, и при одинаковых температурах на всех изобарах и изохорах одинаковые теплоемкости.
Таким образом, для адиабатного процесса по относительному объему или относительному давлению всегда можно определить соответствующую им температуру Т1 и теплоемкости сP1 и сV1. В свою очередь, зная параметры начальной точки этого процесса и степень повышения давления р1/р2 или степень сжатия v1/v2, можно определить параметры конца процесса, найдя π02 = π01(p2/p1) или θ02 = θ01(v2/v1), а по ним определить Т2 и рассчитать весь адиабатный процесс.
В таблицах [12] в качестве Т0 для расчета π0 и θ0 принято значение температуры абсолютного нуля. В принципе, можно брать любое Т0, а Р0 и v0 вообще роли не играют (смотри приведенный выше анализ).
Для определения внутренней энергии и энтальпии газов принимают начало отсчета внутренней энергии u0=0 при Т0. В качестве Т0 в таблицах [9,12] принят абсолютный нуль, Т0=0 К. Расчет u и h ведется по формулам идеальных газов
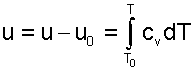 |
(5.53) |
(5.54) |
При этом в нашем случае начало отсчета внутренней энергии и энтальпии совпадают и равны нулю, т.к. Т0= 0 К. Энтальпия может быть рассчитана аналогично расчету внутренней энергии интегрированием, используя функциональную зависимость теплоемкости сP от температуры:
 |
(5.55) |
Поскольку u и h являются функциями температуры, то они могут быть определены и через θ0 и π0.
Для расчета изменения энтропии используется первый закон термодинамики для обратимых процессов идеальных газов
 |
Интегрируя это выражение для двух состояний идеального газа, получим формулу для расчета разности энтропий
 |
(5.56) |
Интегральное слагаемое выражения (5.56) можно представить в виде разности:
 |
(5.57) |
Величины, входящие в эту разность, могут восприниматься как изменение энтропии в зависимости от температуры. Они обозначаются как s01 и s02, и могут быть рассчитаны при фиксации Т0 для каждой температуры. Величина s0 является функцией температуры, а для адиабатного процесса - функцией π0 и θ0. В таблицах [12] s0 рассчитаны при Т0=0 К. Используя табличные значения s0, можно определить разницу энтропий в точках по формуле
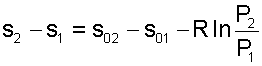 |
(5.58) |
Если требуется абсолютное значение энтропии, необходимо выбрать начало ее отсчета s0=0 при Т0 и Р0. В качестве Т0 и Р0 могут быть приняты любые величины. В случае выбора Т0=0 К, как и в таблицах [12], получим расчетное выражение абсолютной энтропии, например, для точки с Р1 и Т1
 |
(5.59) |

При несоответствии Т0 значению абсолютного нуля для определения s01 и абсолютной энтропии s1 в выражении (5.59) появится дополнительное постоянное вычитаемое
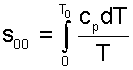 |
(5.60) |
которое уменьшит абсолютное значение энтропии s1, но не скажется на величине изменения энтропии s2-s1. То есть, значение температуры, принятое для начала отсчета абсолютной энтропии, не обязательно должно соответствовать базовой температуре Т0, принятой для расчета табличных величин s0. Так же произволен и выбор значения Р0, для расчета абсолютного значения энтропии.
Величины: сP, cV, u, h, s0, π0, θ0, рассчитанные по формулам (5.32) - (5.45) для различных газов, сводятся в специальные таблицы [12] термодинамических свойств газов. В этих таблицах приводятся величины: сP, cV, u, h, s0, π0, θ0 - в зависимости от температуры. Для расчета адиабатного процесса можно пользоваться всеми, приведенными в таблице величинами. Для расчетов других процессов можно пользоваться только величинами: сP, cV, u, h, s0, как функциями от температуры.
Приведем пример использования этих таблиц для расчетов процессов газов, подчиняющихся уравнению Pv=RT.
Пусть требуется рассчитать обратимый адиабатный процесс сжатия воздуха от состояния Р1=1 бар и t1=17 0С до давления Р2=10 бар, а затем рассчитать количество теплоты и изменение энтропии при охлаждении воздуха при постоянном давлении Р2=const от t2 до t3=20 0С (рис.5.17).
|
|||||
Решение:
По таблицам III-2 [9, 12] определяем π01 по известной температуре t1=17 0C. Определив π01=1,2339, рассчитываем π02 по известному отношению давлений адиабатного процесса:
 |
По величине π02 определяем по таблицам III-2 температуру в конце адиабатного процесса t2 = 283 0C (взято с точностью до 1 градуса). Зная температуры во всех трех точках сложного процесса, определим по ним из таблиц необходимые для расчета энергетические параметры:
Для адиабатного процесса 1-2 определим:
 |
Для изобарного процесса 2-3 количество теплоты рассчитывается как разница его энтальпий:
 |
Для определения изменения энтропии на процессе 2-3 из таблиц III-2 по t2 и t3 возьмем s02=7,3298 кДж/(кг К) и s03=6,6789 кДж/(кг К) и рассчитаем изменение энтропии
 |
Изменение энтропии происходит только за счет изменения температуры, т.к. процесс 2-3 - изобарный.
Для определения абсолютных значений энтропий необходимо задаться величиной Р0. Приняв Р0=1 бар, рассчитаем s1, s2 и s3:
 |
 |
Проверим ранее полученное значение разности энтропий s3-s2 по разности абсолютных энтропий в этих точках:
 |
| предыдущий параграф | содержание | следующий параграф |